Lipopoliszacharidok

A lipopoliszacharidok (LPS) nagy molekulák, melyek lipidből és poliszacharidból állnak, és bakteriális toxinok. O-antigénből, külső magból és belső magból állnak, melyeket kovalens kötések kapcsolnak össze, és Gram-negatív baktériumok külső membránján vannak. Gyakran az endotoxin fogalmát az LPS szinonimájaként használják,[1] azonban vannak endotoxinok (az eredeti értelmükben, vagyis bakteriális sejtben lévő, annak bomlásakor kiszabaduló toxinok), melyek nem kapcsolódnak LPS-hez, például a Bacillus thuringiensis termelte δ-endotoxinok.[2]
A lipopoliszacharidok jelentősen befolyásolhatják az egészséget, elsősorban az immunrendszerre hatva. Hatékony immunaktivátorok és pirogének.[3] Súlyos esetben az LPS szeptikus sokkot is okozhat.[4] Alacsonyabb mennyiségben és hosszabb idő alatt az LPS fontos káros szerepet játszhat az autoimmun betegségekben, az obesitasban, a depresszióban és a senescentiában.[5][6][7][8]
Felfedezés[szerkesztés]
Az LPS mérgező hatását Richard Friedrich Johannes Pfeiffer fedezte fel, és ő nevezte el őket endotoxinoknak, melyek a baktériumon belül lévő toxinok, de csak annak megszűnéséig vannak ott, megkülönböztetve az exotoxinoktól, melyeket a baktérium folyamatosan bocsát ki környezetébe.[9] Később kiderült, hogy a Gram-negatív baktériumokból való LPS-kibocsátáshoz nem mindig szükséges a baktériumsejtfal lebomlása, hanem az LPS a membránvezikulum-forgalom révén normál fiziológiás aktivitás mellett kerül ki a bakteriális külsőmembrán-vezikulumokba, melyek más virulenciafaktorokat és fehérjéket tartalmaznak.[10][11]
Funkciója baktériumokban[szerkesztés]
Az LPS a Gram-negatív baktériumok külső membránjának fő alkotója, jelentősen hozzájárulva a baktériumok szerkezeti épségéhez és a membrán védelméhez bizonyos kémiai támadásoktól. Az LPS a leggyakoribb antigén a legtöbb Gram-negatív baktérium felszínén: az E. coli és a Salmonella külső membránjának akár 80%-át is adhatja.[11] Az LPS növeli a sejtmembrán negatív töltését, és segít stabilizálni a membránszerkezetet. Nagyon fontos számos Gram-negatív baktériumnak, melyek elpusztulnak az azokat kódoló gének mutációja vagy eltűnése esetén. Azonban az LPS legalább egy kevés Gram-negatív baktériumnak nem szükséges – ilyenek a Neisseria meningitidis, a Moraxella catarrhalis és az Acinetobacter baumannii.[12] Szerepe lehet nem patogén hatásokban is, például a felszínadhézióban, a bakteriofág-szenzitivitásban és a predátorokkal, például amőbákkal való kölcsönhatásban. Ezenkívül az LPS szükséges az omptinok (egy baktériumproteáz-osztály) működéséhez.[13]
Összetétel[szerkesztés]
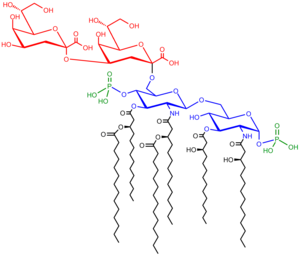
A lipopoliszacharidok 3 részből állnak: az O antigénből (más néven O poliszacharid), a mag-oligoszacharidból és a lipid A-ból.
O-antigén[szerkesztés]
Az O-antigén, más néven O-poliszacharid vagy O-oldallánc ismétlődő glikánpolimer. Ez a mag-oligoszacharidhoz kapcsolódik, és az LPS legkülső része. Összetétele törzsenként eltér: a különböző Escherichia coli-törzsekben több mint 160 eltérő szerkezet van.[14] Az O-láncok jelenléte vagy hiánya határozza meg, hogy az LPS sima vagy durva. A teljes hosszúságú O-láncok sima, hiányuk vagy rövidülésük durva LPS-t jelentenek.[15] A durva LPS-ű baktériumok sejtmembránján általában jobban hatolnak át a hidrofób antibiotikumok, mivel a durva LPS hidrofóbabb.[16] Az O antigén a baktériumsejt legkülső részén van, így a gazdaantitestek célpontja.
Mag[szerkesztés]
A magdoménben mindig van oligoszacharid, mely a lipid A-hoz közvetlenül kapcsolódik, és cukrokat, például heptózokat és 3-dezoxi-d-manno-okt-2-ulozonsavat (KDO, ketodezoxioktulozonát) tartalmaz.[17] Sok baktérium LPS magja tartalmaz nem szénhidrát részeket, például foszfátot, aminosavakat vagy etanolamin szubsztituenseket.
Lipid A[szerkesztés]
A lipid A általában foszforilált glükózamin-diszacharid több zsírsavval. Ezek az LPS-t a baktériummembránba rögzítik, a maradék a sejtfelszínből megy ki. Ez felel sok Gram-negatív baktérium toxicitásáért. A baktériumok lízisekor lipid A-tartalmú membrántöredékek kerülnek a vérbe, lázat, hasmenést és adott esetben szeptikus sokkot okozva. A lipid A rész az LPS nagyon állandó része.[18] Azonban a lipid A szerkezete eltér a baktériumfajok közt. Ez határozza meg a a gazda immunaktivációját.[19]
Lipooligoszacharidok[szerkesztés]
Az LPS „durva” alakja kisebb az O-poliszacharid hiánya miatt, mely helyett oligoszacharid van. Ez a lipooligoszacharid, mely egyes Gram-negatív baktériumok, például a Neisseria és a Haemophilus spp. külső membránján van.[5][20] A LOS a Gram-negatív baktériumok külső membránjának épségét és működőképességét tartja fenn. Fontos egyes baktériumfertőzések patogenezisében, mivel képes immunstimulánsként és immunmodulátorként hatni.[5] Továbbá lehetővé teszik egyes baktériumtörzsek molekuláris mimikrijét és az antigéndiverzitást, segítve a gazda immunitásának kivédését és a bakteriális törzsek virulenciáját. A Neisseria meningitidisnél a lipid A szimmetrikus, a belső mag 3-dezoxi-d-manno-okt-2-ulozonsav- (KDO) és heptóz (Hep) részből áll, a külső pedig a törzstől függ.[5][20]
Hatástalanítása[szerkesztés]
Egy nagyon állandó gazdaenzim, az aciloxiacil-hidroláz képes az LPS hatástalanítására szövetekbe való belépésekor vagy ottani termelődésükkor. Ezenkívül a bélben lévő LPS-t LPS-gátlóvá alakíthatja. Ily lipázt termelnek a neutrofilok, a makrofágok és a dendritsejtek, mely inaktiválja az LPS-t a lipid A két szekunder acilláncának eltávolításához tetraacil-LPS-t eredményezve. Egereknek beadva LPS-t az AOAH-hiányos egerekben megnő a nem specifikus antitestek száma, hosszú krónikus hepatomegália és elhúzódó endotoxin-tolerancia jelentkezik. Az LPS-inaktiváció szükség lehet az állatoknak a homeosztázis helyreállítására a neki való kitettség után.[21] Bár az LPS-szignál akadályozására van sok más módszer, ezek egyike se képes a változás megakadályozására az AOAH-hiányos állatokban.
Az LPS bélfoszfatáz általi defoszforilációja csökkentheti a Salmonella tryphimurium és a Clostridioides difficile fertőzésének súlyosságát a normál bélmikrobiom helyreállításával.[22] Ez megakadályozza a baktériumok okozta gyulladást és a „szivárgó beleket” a lipid A defoszforilációjával.[23][24][25]
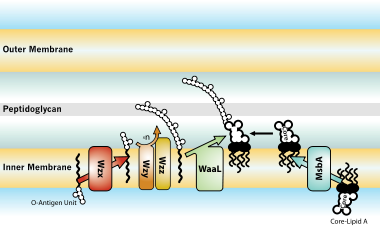
Bioszintézis és transzport[szerkesztés]

Biológiai hatások a Gram-negatív baktériumokkal fertőzöttekre[szerkesztés]
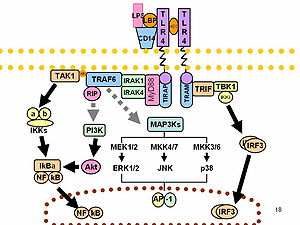
Immunválasz[szerkesztés]
Az LPS a legfőbb endotoxin, mivel a CD14/TLR4/MD2 receptorkomplexhez kötődik számos sejttípusban, különösen a monocitákban, a makrofágokban és a B-sejtekben, mely a citokin-, a nitrogén-monoxid- és az eikozanoidszekréciót erősíti.[28] Bruce Beutler a 2011-es fiziológiai vagy orvostudományi Nobel-díj egy részét annak bemutatásáért kapta, hogy a TLR4 LPS-receptor.[29][30]
A sejt stresszválaszának részeként a szuperoxid az egyik fő reaktív oxigéngyök, melyet az LPS indukál sok TLR-t expresszáló sejttípusban.[31] Az LPS továbbá exogén pirogén (lázokozó anyag).[3]
Az LPS-funkcióval néhány évig kísérleteztek, mivel számos transzkripciós faktort aktivál. Az LPS számos, a szeptikus sokkban résztvevő mediátort termel. Az ember sokkal érzékenyebb az LPS-re más állatoknál, például egereknél: 1 μg/kg LPS elég emberben a szeptikus sokkhoz, de az egér 1000-szer annyit tolerál.[32] Ennek oka lehet a természetes antitestek szintje közti eltérés a két faj közt.[33][34] Said et al. kimutatták, hogy az LPS a CD4 T-sejtek tágulásának IL-10-függő akadályozását okozza, és a PD-1-szinteket növeli a monocitákon, ami az azok általi IL-10-termelést okozza a PD-1 PD-L1 általi kötése után.[35]
Az endotoxinok felelnek főképp a Gram-negatív patogének, például a meningococcalis betegségeket, például meningococcaemiát, Waterhouse–Friderichsen-szindrómát és meningitist okozó Neisseria meningitidis általi fertőzés súlyosságához.
Számos baktériumtörzs LPS-ének részei kémiailag hasonlók a gazdasejt felszínén lévő molekulákhoz (molekuláris mimikri).[36] Például a Neisseria meningitidis L2, 3, 5, 7, 9-nél az oligoszacharid végén lévő tetraszacharid (lakto-N-neotetraóz) azonos a humán eritrociták ABH glikolipidje, a paraglobozid tetraszacharidjával.[5] A patogén Neisseria-fajok LOS-ának triszacharidja (laktotriaóz) megtalálható a humán sejteken lévő glikoszfingolipidekben is.[5] Számos meningococcus B és C, valamint a gonococcusok LOS-szerkezete rendelkezik e triszachariddal.[5] E mimikri nemcsak álca az immunrendszer elől, hanem az immuntolerancia megszüntetésében is szerepet játszhatnak egyes humán leukocita-antigénekkel, például HLA-B35-tel való fertőzéskor.[5]
Az LPS-t érzékelhetik a vérképző őssejtek (HSC) a TLR4-kötéssel, mely proliferációjukat okozza szisztémás fertőzés esetén. Ez aktiválja a TLR4-TRIF-ROS-p38 jelzést a HSC-kben, és proliferatív stresszt okozhatnak, a kompetitív megújítási képességet csökkentve.[37] Egerek S. typhimurium-fertőzése hasonló eredményt adott, érvényessé téve a kísérleti modellt in vivo.
A változékonyság hatása az immunválaszra[szerkesztés]
Az O-antigének az LPS legváltozékonyabb részei, így azok antigénspecifikusak. Ezzel szemben a lipid A a legállandóbb. Azonban a lipid A összetétele is eltérhet (az acilláncok számában és természetében – akár nemzetségen belül vagy azok közt is). Néhány ilyen változás antagonisztikus tulajdonságokat adhat az LPS-nek. Például a Rhodobacter sphaeroides difoszforil-lipid A-ja a humán sejtekben LPS-antagonista, de a hörcsög- és lósejtekben agonista.[38]
Feltehetően a kúposabb lipid A (például az E. colié) jobb agonista, a kevésbé kúpos, például a Porphyromonas gingivalisé, más szignált aktiválhat (TLR2-t a TLR4 helyett), a teljesen kúpos, például a Rhodobacter sphaeroidesé TLR-antagonista.[39][40] Általában az LPS-géncsoportok az egyes patogéntörzsek, -alfajok és -fajok közt erősen eltérnek.[41][42]
A normál humán vérszérum baktericid anti-LOS antitesteket tartalmaznak, és az eltérő szerotípusú törzsekkel fertőzött betegek eltérő specificitású antitesteket tartalmaznak a normál szérumhoz képest.[43] Ennek oka a LOS szerkezete, különösen az oligoszacharid részéé.[43] A Neisseria gonorrhoeaeben kimutatták, hogy a LOS antigenitása változhat a fertőzés során, mivel e baktériumok 1-nél több LOS-típust szintetizálhatnak (fázisvariáció).[43] Továbbá a Neisseria gonorrhoeae a Neisseria meningitidishez és a Haemophilus influenzaehez hasonlóan[5] képes tovább módosítani a LOS-t in vitro, például szialilációval (sziálsavrészlettel történő módosítás), növelve a komplementmediált támadáshoz,[43] csökkentheti a komplementrendszer aktivációját,[5] vagy kikerülheti a baktericid antitestek hatásait.[5] A szialiláció hozzájárulhat a gátolt neutrofilkötéshez és immunsejtek által történő fagocitózishoz, valamint a kisebb oxidatív stresszhez.[5] A Haemophilus somnus, egy marhapatogén szintén mutatott LOS-fázisvariációt, ami segítheti a marha immunrendszerének kivédésében.[44] E megfigyelések alapján tehát a baktériumok felszíni molekuláinak, például a LOS-nak a változásai segítheti a patogén humorális és sejtmediált immunitás elleni védelmét.
Nem kanonikus LPS-felismerési útvonalak[szerkesztés]
2018-ban felfedezték, hogy a TLR4-mediált útvonalak mellett egyes tranziens receptorpotenciál-ioncsatornák is felismerik az LPS-t.[45] A TRPA1 LPS-mediált aktivációját kimutatták egerekben[46] és Drosophila melanogasterben.[47] Nagyobb koncentrációban az LPS más TRP csatornákat is aktivál, például a TRPV1-et, a TRPM3-at és bizonyos mértékig a TRPM8-at is.[48] Az LPS-t epitélsejteken a TRPV4 ismeri fel. A TRPV4 LPS általi aktivációja szükséges és elegendő a nitrogén-monoxid-termeléshez.[49]
Egészségi hatások[szerkesztés]
Az LPS egészségi hatásainak alapvető okai az immunaktivációs és -modulációs, különösen gyulladásokozó képessége.
Endotoxémia[szerkesztés]
Az endotoxinok jelenléte a vérben az endotoxémia. A magas endotoxinszint szeptikus sokkot okoz,[50] az alacsonyabb a metabolikus endotoxémia.[51] Az endotoxémia kapcsolatban állhat az elhízással, az étrenddel,[52] a szív- és érrendszeri megbetegedésekkel[52] és a cukorbetegséggel,[51] de ezt a gazda genomja is befolyásolhatja.[53]
Ezenkívül a béleredetű endotoxémia, különösen a gazda-patogén felületnél, fontos tényező az alkoholos hepatitiszben,[54] mely valószínűleg vékonybélbaktériumtúlburjánzás-szindróma és megnövekedett bélpermeabilitás miatt alakul ki.[55]
A lipid A az emlősök immunrendszerének irányítatlan aktivációját okozhatja gyulladásmediátorokkal, ami szeptikus sokkhoz vezethet.[20] E reakciót a Toll-típusú receptor 4 mediálja, mely az immunsejt-aktivációért felel.[20] Az erek endotél rétegének ezek által okozott sérülése kapilláris szivárgáshoz, vazodilatációhoz, szívfunkció-csökkenéshez és szeptikus sokkhoz vezethet.[56] Jelentős komplementaktiváció is megfigyelhető később a baktériumok osztódása révén.[56] A nagy bakteriális proliferáció kiterjedt intravaszkuláris koagulációhoz (DIC) vezethet egyes szervek, például a vese, a mellékvesék és a tüdő funkciójának elvesztésével a nem megfelelő vérellátás miatt. A bőr a gyakran a koagulációs faktorok csökkenésével együtt jelentkező érsérülés hatásait is mutatja petechiák, purpura és ecchymosis formájában. A végtagok is érintettek lehetnek, bizonyos esetekben akár üszkösödés is kialakulhat.[56] A mellékvese-funkció megszűntének következménye mellékvese-elégtelenség, a mellékvesékbe való vérzésé Waterhouse–Friderichsen-szindróma, melyek mindegyike életveszélyes lehet.
A gonococcalis LOS sérülést okozhat a humán petevezetékben.[43]
Autoimmun betegség[szerkesztés]
Egyes LOS-molekulák molekuláris mimikrije feltehetően autoimmunitást okozó gazdaválaszokat, például sclerosis multiplexet okozhat.[5][36] További példák a gazdaszervezetek baktériumok általi mimikrijére az emberben gyomor-bél betegséget okozó Helicobacter pyloriban és a Campylobacter jejuniban és a chancroidát okozó Haemophilus ducreyi. Egyes C. jejuni-szerotípusok Guillain–Barré-szindróma és annak változata, a Miller–Fisher-szindróma okozói. Ennek okai bizonyos tetra- és pentaszacharidok a LOS-ban.[5]
Elhízás[szerkesztés]
Epidemiológiai tanulmányok szerint a nagyobb LPS-mennyiség, amit a több endotoxin-termelő baktérium okozhat, egyes elhízással kapcsolatos betegségekben is közrejátszhat.[6][57][58] Más tanulmányok szerint a tisztított E. coli-LPS elhízást és inzulinrezisztenciát okozhat csíramentes egérmodellekben.[59] Egy 2012-es tanulmány az Enterobacter cloacae B29 lehetséges közreműködését vizsgálta egy ember elhízásában és inzulinrezisztenciájában.[60] Az LPS és az elhízás kapcsolatának feltételezett módja, hogy az endotoxin gyulladásmediált útvonalat hoz létre, mely az észlelt elhízást és az inzulinrezisztenciát okozza.[59] Kapcsolódó baktériumnemzetségek például az Escherichia és az Enterobacter.
Depresszió[szerkesztés]
Kísérletekből és megfigyelésekből is igazolhatónak bizonyult, hogy az LPS a depresszióban közrejátszhat. LPS egereknek adása depresszív tünetekhez vezethet, és egyes depressziós emberekben nagyobb az LPS-szint. A gyulladás közrejátszhat benne, és az LPS azt segíti.[7]
Sejtöregedés[szerkesztés]
Az LPS okozta gyulladás sejtöregedést okozhat például a tüdő epitél- és a mikrogliasejtek esetén (utóbbi neurodegenerációhoz vezet).[8]
Szennyezőanyagként[szerkesztés]
A lipopoliszacharidok gyakori szennyeződések a baktériumokból preparált plazmid-DNS-ben és a bennük kifejezett fehérjékben, és eltávolítandó a kísérletek szennyezését és a fermentációval előállított termékek toxicitását elkerülendő.[61]
Az állatmodellekben az egyik leggyakrabban tanulmányozott fehérje, az ovalbumin gyakran tartalmaz endotoxint. Ez gyakori modellallergén légúti hiperreszponzivitásra (AHR). Az LPS-tartalmú ovalbumin eredményeket hamisíthat, mivel a pontos allergénhatást nem adja vissza.[62]
A gyógyszergyártásban szükséges minden endotoxinnyom eltávolítása a gyógyszertároló edényekből, mivel kevés endotoxin is betegséget tud okozni. Erre depirogenációs kemencét használnak, mivel több mint 300 °C-os hőmérséklet kell az LPS teljes bontásához.[63]
Az endotoxin észlelésére használatos standard assay a limulus-amőbocita-lizátum (LAL) assay, mely a patkórák (Limulus polyphemus) amőbocitáit használja.[64] A lizátum koagulációját nagyon kevés LPS is okozza az enzimkaszkád révén történő nagymértékű erősítés miatt. Azonban a patkórák csökkenő mennyisége és a LAL-lel kölcsönható faktorok miatt alternatív assay-ket hoztak létre, például az ELISA teszteket, melyek a LAL rekombináns változatát, a faktor C-t használják.[65]
Jegyzetek[szerkesztés]
- ↑ (1994) „Bacterial endotoxin: molecular relationships of structure to activity and function”. FASEB J. 8 (2), 217–25. o. DOI:10.1096/fasebj.8.2.8119492. PMID 8119492.
- ↑ (1986. december 1.) „Structural and functional analysis of a cloned delta endotoxin of Bacillus thuringiensis berliner 1715”. European Journal of Biochemistry 161 (2), 273–280. o. DOI:10.1111/j.1432-1033.1986.tb10443.x. ISSN 0014-2956. PMID 3023091.
- ↑ a b (2014. október 1.) „Mechanisms of fever production and lysis: lessons from experimental LPS fever”. Comprehensive Physiology 4 (4), 1563–1604. o. DOI:10.1002/cphy.c130033. ISSN 2040-4603. PMID 25428854.
- ↑ (2013. február 1.) „Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012”. Critical Care Medicine 41 (2), 580–637. o. DOI:10.1097/CCM.0b013e31827e83af. ISSN 1530-0293. PMID 23353941.
- ↑ a b c d e f g h i j k l m n (1996) „Molecular mimicry of host structures by bacterial lipopolysaccharides and its contribution to disease”. FEMS Immunol. Med. Microbiol. 16 (2), 105–115. o. DOI:10.1016/s0928-8244(96)00072-7. PMID 8988391.
- ↑ a b (2012) „Circulating lipopolysaccharide-binding protein (LBP) as a marker of obesity-related insulin resistance”. Int J Obes (Lond) 36 (11), 1442–1449. o. DOI:10.1038/ijo.2011.256. PMID 22184060.
- ↑ a b (2020. augusztus 1.) „Comparison of bacterial lipopolysaccharide-induced sickness behavior in rodents and humans: Relevance for symptoms of anxiety and depression”. Neuroscience and Biobehavioral Reviews 115, 15–24. o. DOI:10.1016/j.neubiorev.2020.05.001. ISSN 1873-7528. PMID 32433924.
- ↑ a b (2018) „Cellular senescence: Molecular mechanisms and pathogenicity”. Journal of Cellular Physiology 233 (12), 9121–9135. o. DOI:10.1002/jcp.26956. PMID 30078211.
- ↑ Parija SC. Textbook of Microbiology & Immunology. India: Elsevier (2009). ISBN 978-8131221631
- ↑ (2010) „Biological functions and biogenesis of secreted bacterial outer membrane vesicles”. Annu. Rev. Microbiol. 64, 163–184. o. DOI:10.1146/annurev.micro.091208.073413. PMID 20825345.
- ↑ a b (2021) „Outer Membrane Vesicles of Gram-Negative Bacteria: An Outlook on Biogenesis”. Frontiers in Microbiology 12, 557902. o. DOI:10.3389/fmicb.2021.557902. PMID 33746909.
- ↑ (2013) „On the essentiality of lipopolysaccharide to Gram-negative bacteria”. Curr. Opin. Microbiol. 16 (6), 779–785. o. DOI:10.1016/j.mib.2013.09.007. PMID 24148302.
- ↑ (2004. július 1.) „The omptin family of enterobacterial surface proteases/adhesins: from housekeeping in Escherichia coli to systemic spread of Yersinia pestis”. International Journal of Medical Microbiology 294 (1), 7–14. o. DOI:10.1016/j.ijmm.2004.01.003. ISSN 1438-4221. PMID 15293449.
- ↑ (2002) „Lipopolysaccharide endotoxins”. Annu. Rev. Biochem. 71, 635–700. o. DOI:10.1146/annurev.biochem.71.110601.135414. PMID 12045108.
- ↑ (2003) „Smooth and rough lipopolysaccharide phenotypes of Brucella induce different intracellular trafficking and cytokine/chemokine release in human monocytes”. J. Leukoc. Biol. 74 (6), 1045–55. o. DOI:10.1189/jlb.0103015. PMID 12960272.
- ↑ (1999) „Diffusion of macrolide antibiotics through the outer membrane of Moraxella catarrhalis”. J. Infect. Chemother. 5 (4), 196–200. o. DOI:10.1007/s101560050034. PMID 11810516.
- ↑ (1968) „Chemistry and metabolism of 3-deoxy-D-mannooctulosonic acid. I. Stereochemical determination”. J. Biol. Chem. 243 (7), 1578–84. o. DOI:10.1016/S0021-9258(18)93581-7. PMID 4296687. [halott link]
- ↑ (2002. május 1.) „Endotoxin of Neisseria meningitidis composed only of intact lipid A: inactivation of the meningococcal 3-deoxy-D-manno-octulosonic acid transferase”. J. Bacteriol. 184 (9), 2379–2388. o. DOI:10.1128/JB.184.9.2379-2388.2002. PMID 11948150.
- ↑ (2018. június 24.) „Mass Spectrometry-based Structural Analysis and Systems Immunoproteomics Strategies for Deciphering the Host Response to Endotoxin”. Journal of Molecular Biology 430 (17), 2641–2660. o. DOI:10.1016/j.jmb.2018.06.032. ISSN 1089-8638. PMID 29949751.
- ↑ a b c d (2013) „Structural characterization of bacterial lipopolysaccharides with mass spectrometry and on- and off-line separation techniques”. Mass Spectrom Rev 32 (2), 90–117. o. DOI:10.1002/mas.21352. PMID 23165926.
- ↑ Kill the Bacteria...and Also Their Messengers?, Advances in Immunology, 29–48. o.. DOI: 10.1016/S0065-2776(09)03002-8 (2009). ISBN 9780123748324
- ↑ (2017) „The Role of Intestinal Alkaline Phosphatase in Inflammatory Disorders of Gastrointestinal Tract”. Mediators of Inflammation 2017, 9074601. o. DOI:10.1155/2017/9074601. PMID 28316376.
- ↑ (2007) „Intestinal alkaline phosphatase detoxifies lipopolysaccharide and prevents inflammation in zebrafish in response to the gut microbiota”. Cell Host & Microbe 2 (6), 371–382. o. DOI:10.1016/j.chom.2007.10.010. PMID 18078689.
- ↑ (2014. április 1.) „Intestinal alkaline phosphatase prevents antibiotic-induced susceptibility to enteric pathogens”. Annals of Surgery 259 (4), 715–22. o. DOI:10.1097/sla.0b013e31828fae14. PMID 23598380.
- ↑ (2014. február 1.) „Intestinal alkaline phosphatase: novel functions and protective effects”. Nutrition Reviews 72 (2), 82–94. o. DOI:10.1111/nure.12082. PMID 24506153.
- ↑ (2010) „Lipopolysaccharide: Biosynthetic pathway and structure modification”. Prog. Lipid Res. 49 (2), 97–107. o. DOI:10.1016/j.plipres.2009.06.002. PMID 19815028.
- ↑ (2009) „Transport of lipopolysaccharide across the cell envelope: the long road of discovery”. Nat. Rev. Microbiol. 7 (9), 677–683. o. DOI:10.1038/nrmicro2184. PMID 19633680.
- ↑ Abbas, Abul. Basic Immunology. Elsevier (2006). ISBN 978-1-4160-2974-8
- ↑ (1998) „Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: mutations in Tlr4 gene”. Science 282 (5396), 2085–8. o. DOI:10.1126/science.282.5396.2085. PMID 9851930.
- ↑ The 2011 Nobel Prize in Physiology or Medicine - Press Release. www.nobelprize.org . [2018. március 23-i dátummal az eredetiből archiválva]. (Hozzáférés: 2018. április 28.)
- ↑ (2019. június 12.) „Roles of Toll-Like Receptors in Nitroxidative Stress in Mammals”. Cells 8 (6), 576. o. DOI:10.3390/cells8060576. ISSN 2073-4409. PMID 31212769.
- ↑ (2010) „Resilience to bacterial infection: difference between species could be due to proteins in serum”. J. Infect. Dis. 201 (2), 223–232. o. DOI:10.1086/649557. PMID 20001600.
- ↑ (1997) „Endotoxin shock in antibody-deficient mice: unraveling the role of natural antibody and complement in the clearance of lipopolysaccharide”. J. Immunol. 159 (2), 970–975. o. DOI:10.4049/jimmunol.159.2.970. PMID 9218618.
- ↑ (1998) „A critical role of natural immunoglobulin M in immediate defense against systemic bacterial infection”. J. Exp. Med. 188 (12), 2381–6. o. DOI:10.1084/jem.188.12.2381. PMID 9858525.
- ↑ (2010) „Programmed death-1-induced interleukin-10 production by monocytes impairs CD4+ T cell activation during HIV infection”. Nat. Med. 16 (4), 452–459. o. DOI:10.1038/nm.2106. PMID 20208540.
- ↑ a b (2012) „Molecular mimicry as an inducing trigger for CNS autoimmune demyelinating disease”. Immunol. Rev. 245 (1), 227–38. o. DOI:10.1111/j.1600-065X.2011.01076.x. PMID 22168423.
- ↑ (2017. augusztus 3.) „Pathogen-Induced TLR4-TRIF Innate Immune Signaling in Hematopoietic Stem Cells Promotes Proliferation but Reduces Competitive Fitness”. Cell Stem Cell 21 (2), 225–240.e5. o. DOI:10.1016/j.stem.2017.06.013. ISSN 1875-9777. PMID 28736216.
- ↑ (2007) „The equine TLR4/MD-2 complex mediates recognition of lipopolysaccharide from Rhodobacter sphaeroides as an agonist”. Journal of Endotoxin Research 13 (4), 235–242. o. DOI:10.1177/0968051907083193. PMID 17956942.
- ↑ (2002) „Does the shape of lipid A determine the interaction of LPS with Toll-like receptors?”. Trends Immunol. 23 (3), 135–139. o. DOI:10.1016/S1471-4906(01)02169-X. PMID 11864841.
- ↑ (2000) „Intrinsic conformation of lipid A is responsible for agonistic and antagonistic activity”. Eur. J. Biochem. 267 (10), 3032–3039. o. DOI:10.1046/j.1432-1033.2000.01326.x. PMID 10806403.
- ↑ Genomic Organization of LPS-Specific Loci, Pathogenicity Islands and the Evolution of Pathogenic Microbes, Current Topics in Microbiology and Immunology, 109–135. o.. DOI: 10.1007/978-3-642-56031-6_7. 264 (2002). ISBN 978-3-540-42682-0
- ↑ (2004) „Variation suggestive of horizontal gene transfer at a lipopolysaccharide (lps) biosynthetic locus in Xanthomonas oryzae pv. oryzae, the bacterial leaf blight pathogen of rice”. BMC Microbiol. 4, 40. o. DOI:10.1186/1471-2180-4-40. PMID 15473911.
- ↑ a b c d e (1994) „The structure of lipooligosaccharide produced by Neisseria gonorrhoeae, strain 15253, isolated from a patient with disseminated infection. Evidence for a new glycosylation pathway of the gonococcal lipooligosaccharide”. J. Biol. Chem. 269 (48), 30345–30351. o. DOI:10.1016/S0021-9258(18)43819-7. PMID 7982947.
- ↑ (2000) „Antigenic diversity of Haemophilus somnus lipooligosaccharide: phase-variable accessibility of the phosphorylcholine epitope”. J. Clin. Microbiol. 38 (12), 4412–4419. o. DOI:10.1128/JCM.38.12.4412-4419.2000. PMID 11101573.
- ↑ (2018. augusztus 11.) „TRP Channels as Sensors of Bacterial Endotoxins” (angol nyelven). Toxins 10 (8), 326. o. DOI:10.3390/toxins10080326. PMID 30103489.
- ↑ (2014. január 20.) „TRPA1 channels mediate acute neurogenic inflammation and pain produced by bacterial endotoxins”. Nature Communications 5, 3125. o. DOI:10.1038/ncomms4125. PMID 24445575.
- ↑ (2016. június 14.) „Gustatory-mediated avoidance of bacterial lipopolysaccharides via TRPA1 activation in Drosophila”. eLife 5. DOI:10.7554/eLife.13133. PMID 27296646.
- ↑ (2018. július 1.) „Differential effects of lipopolysaccharide on mouse sensory TRP channels”. Cell Calcium 73, 72–81. o. DOI:10.1016/j.ceca.2018.04.004. PMID 29689522.
- ↑ (2017. október 20.) „TRPV4 activation triggers protective responses to bacterial lipopolysaccharides in airway epithelial cells”. Nature Communications 8 (1), 1059. o. DOI:10.1038/s41467-017-01201-3. PMID 29057902.
- ↑ Endotoxins and other sepsis triggers, Endotoxemia and Endotoxin Shock, Contributions to Nephrology, 14–24. o.. DOI: 10.1159/000315915 (2010). ISBN 978-3-8055-9484-4
- ↑ a b (2017. március 1.) „Metabolic endotoxemia and diabetes mellitus: A systematic review” (angol nyelven). Metabolism 68, 133–144. o. DOI:10.1016/j.metabol.2016.12.009. PMID 28183445.
- ↑ a b (2015. április 1.) „Endotoxemia, nutrition, and cardiometabolic disorders” (angol nyelven). Acta Diabetologica 52 (2), 395–404. o. DOI:10.1007/s00592-014-0662-3. ISSN 0940-5429. PMID 25326898.
- ↑ (2021. október 20.) „Genetic Profile of Endotoxemia Reveals an Association With Thromboembolism and Stroke” (angol nyelven). Journal of the American Heart Association 10 (21), e022482. o. DOI:10.1161/JAHA.121.022482. ISSN 2047-9980. PMID 34668383.
- ↑ (2006) „Acute alcoholic hepatitis”. J. Clin. Gastroenterol. 40 (9), 833–841. o. DOI:10.1097/01.mcg.0000225570.04773.5d. PMID 17016141.
- ↑ (2000) „Increased intestinal permeability to macromolecules and endotoxemia in patients with chronic alcohol abuse in different stages of alcohol-induced liver disease”. J. Hepatol. 32 (5), 742–747. o. DOI:10.1016/S0168-8278(00)80242-1. PMID 10845660.
- ↑ a b c (2007) „Epidemic meningitis, meningococcaemia, and Neisseria meningitidis”. Lancet 369 (9580), 2196–2210. o. DOI:10.1016/S0140-6736(07)61016-2. PMID 17604802.
- ↑ (2007) „Association of lipopolysaccharide-binding protein and coronary artery disease in men”. J. Am. Coll. Cardiol. 50 (1), 25–31. o. DOI:10.1016/j.jacc.2007.02.070. PMID 17601541.
- ↑ (2007) „Lipopolysaccharide-binding protein plasma levels and liver TNF-alpha gene expression in obese patients: evidence for the potential role of endotoxin in the pathogenesis of non-alcoholic steatohepatitis”. Obes Surg 17 (10), 1374–80. o. DOI:10.1007/s11695-007-9243-7. PMID 18000721.
- ↑ a b (2007) „Metabolic endotoxemia initiates obesity and insulin resistance”. Diabetes 56 (7), 1761–72. o. DOI:10.2337/db06-1491. PMID 17456850.
- ↑ (2012. december 1.) „An opportunistic pathogen isolated from the gut of an obese human causes obesity in germfree mice”. ISME J 7 (4), 880–884. o. DOI:10.1038/ismej.2012.153. PMID 23235292.
- ↑ (1995. március 1.) „Bacterial Lipopolysaccharide Copurifies with Plasmid DNA: Implications for Animal Models and Human Gene Therapy”. Human Gene Therapy 6 (3), 317–323. o. DOI:10.1089/hum.1995.6.3-317. PMID 7779915.
- ↑ (2003. október 24.) „Endotoxin contamination of ovalbumin suppresses murine immunologic responses and development of airway hyper-reactivity”. The Journal of Biological Chemistry 278 (43), 42361–42368. o. DOI:10.1074/jbc.M307752200. ISSN 0021-9258. PMID 12909619.
- ↑ 16 December 2014: The Detection of Endotoxins Via the LAL Test, the Chromogenic Method. [2015. március 29-i dátummal az eredetiből archiválva]. (Hozzáférés: 2015. március 14.)
- ↑ (2007) „Biochemical principle of Limulus test for detecting bacterial endotoxins”. Proc. Jpn. Acad., Ser. B, Phys. Biol. Sci. 83 (4), 110–119. o. DOI:10.2183/pjab.83.110. PMID 24019589.
- ↑ (2001) „A new era in pyrogen testing”. Trends Biotechnol. 19 (8), 277–81. o. DOI:10.1016/s0167-7799(01)01694-8. PMID 11451451. (Hozzáférés: 2014. január 2.)
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Lipopolysaccharide című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
További információk[szerkesztés]
- Lipopolysaccharides a U.S. National Library of Medicine Medical Subject Headings (MeSH) honlapján
