Szén-trioxid
| Szén-trioxid | |
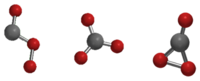 A szén-trioxid három izomerje a Cs, a D3h és a C2V | |
| Kémiai és fizikai tulajdonságok | |
|---|---|
| Kémiai képlet | CO3 |
| Moláris tömeg | 60,01 g/mol |
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |
A szén-trioxid (CO3) egy instabil szén-oxid. Elméleti módszerekkel főleg három izomerjét – Cs, D3h és C2v – tanulmányozták, és kimutatták, hogy a C2v a molekula alapállapota.[1][2]
Szén-trioxid előállítható például úgy, hogy negatív koronakisülésben reagáltatnak szén-dioxidot (CO2) és molekuláris oxigénből a plazma szabad elektronjai hatására keletkező atomos oxigént (O):[3]
Másik módszer az előállítására a folyékony szén-dioxidban vagy szén-dioxid és kén-hexafluorid keverékében oldott ózon (O3) 253,7 nm-es fény hatására végbemenő fotolízise. A szén-trioxid kevesebb mint egy percig létezik, szén-dioxidra és oxigénre (O2) bomlik:[4]
A szén-trioxidot elő lehet állítani ózon és szárazjég (szilárd szén-dioxid) reakciójával, de létezését kimutatták szén-monoxid és molekuláris oxigén (O2) reakciójában is.
A c2v izomer szén-monoxid és oxigén egyesülésével is keletkezhet:[forrás?]
CO + O2 = CO3
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Carbon trioxide című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Jegyzetek[szerkesztés]
- ↑ Tim Kowalczyk, Electronic structure and spectroscopy of carbon trioxide Archiválva 2010. augusztus 2-i dátummal a Wayback Machine-ben
- ↑ T. Kowalczyk and A. I. Krylov (2007. Aug). „Electronic structure of carbon trioxide and vibronic interactions involving Jahn-Teller states”. Journal of Physical Chemistry A 111 (33), 8271–8276. o. DOI:10.1021/jp073627d. ISSN 1089-5639. PMID 17661455.
- ↑ (1971) „A theoretical study of the structure and properties of carbon trioxide”. Chemical Physics Letters 11 (5,), 593–597. o. DOI:10.1016/0009-2614(71)87010-0.
- ↑ DeMore W. B., Jacobsen C. W. (1969). „Formation of carbon trioxide in the photolysis of ozone in liquid carbon dioxide”. Journal of Physical Chemistry 73 (9), 2935–2938. o. DOI:10.1021/j100843a026.


